Cetonas
¿Qué son?
Son compuestos orgánicos que contienen un grupo funcional caracterizado por un átomo de carbono unido a un doble enlace con un átomo de oxígeno (grupo carbonilo, C=O), y ese átomo de carbono está también enlazado a otros dos átomos de carbono.
Donde R y R' son grupos alquilo o arilo (grupos hidrocarburos).
Propiedades
Propiedades químicas
Reactividad moderada: El grupo carbonilo (C=O) es polar, lo que hace que las cetonas participen en reacciones como nucleofílicas, pero son menos reactivas que los aldehídos.
Capacidad de formar cetales: Pueden reaccionar con alcoholes en presencia de ácidos para formar cetales, un tipo de derivado útil en síntesis orgánica
Resistencia a la oxidación: Solo bajo condiciones severas puede llegar a oxidarse en un acido carboxílico, como por ejemplo con oxidantes fuertes o temperaturas por encima de 100°C.
No reactividad con la prueba de Tollens: Las cetonas carecen de un hidrógeno en el carbono adyacente al grupo carbonilo, una característica esencial para que ocurra la oxidación con el reactivo de Tollens, que es el nitrato de plata amoniacal ([Ag(NH₃)₂]⁺), un oxidante suave que oxida aldehídos, transformándolos en ácidos carboxílicos, pero no afecta a las cetonas.
Propiedades físicas
Estado físico: La acetona es un líquido incoloro a temperatura ambiente.
Olor: Tiene un olor característico y penetrante, similar al de las gotas de pera.
Volatilidad: Es un líquido altamente volátil, lo que significa que se evapora rápidamente a temperatura ambiente.
Inflamabilidad: La acetona es inflamable, lo que requiere precauciones al manejarla.
Punto de ebullición: Su punto de ebullición es de aproximadamente 56 °C (132.8 °F)
Solubilidad: Es soluble en agua, así como en muchos disolventes orgánicos, lo que la hace útil en diversas aplicaciones industriales y de laboratorio.

Reconocimiento
El reconocimiento de cetonas en química se puede hacer a través de varias técnicas, algunas serian:
Cromatografía:
Permite separar y detectar cetonas a través de la interacción con un adsorbente, ya que las cetonas tienen características polares y volátiles ,es decir, interactúan de manera diferenciada con el adsorbente, lo que permite su separación.
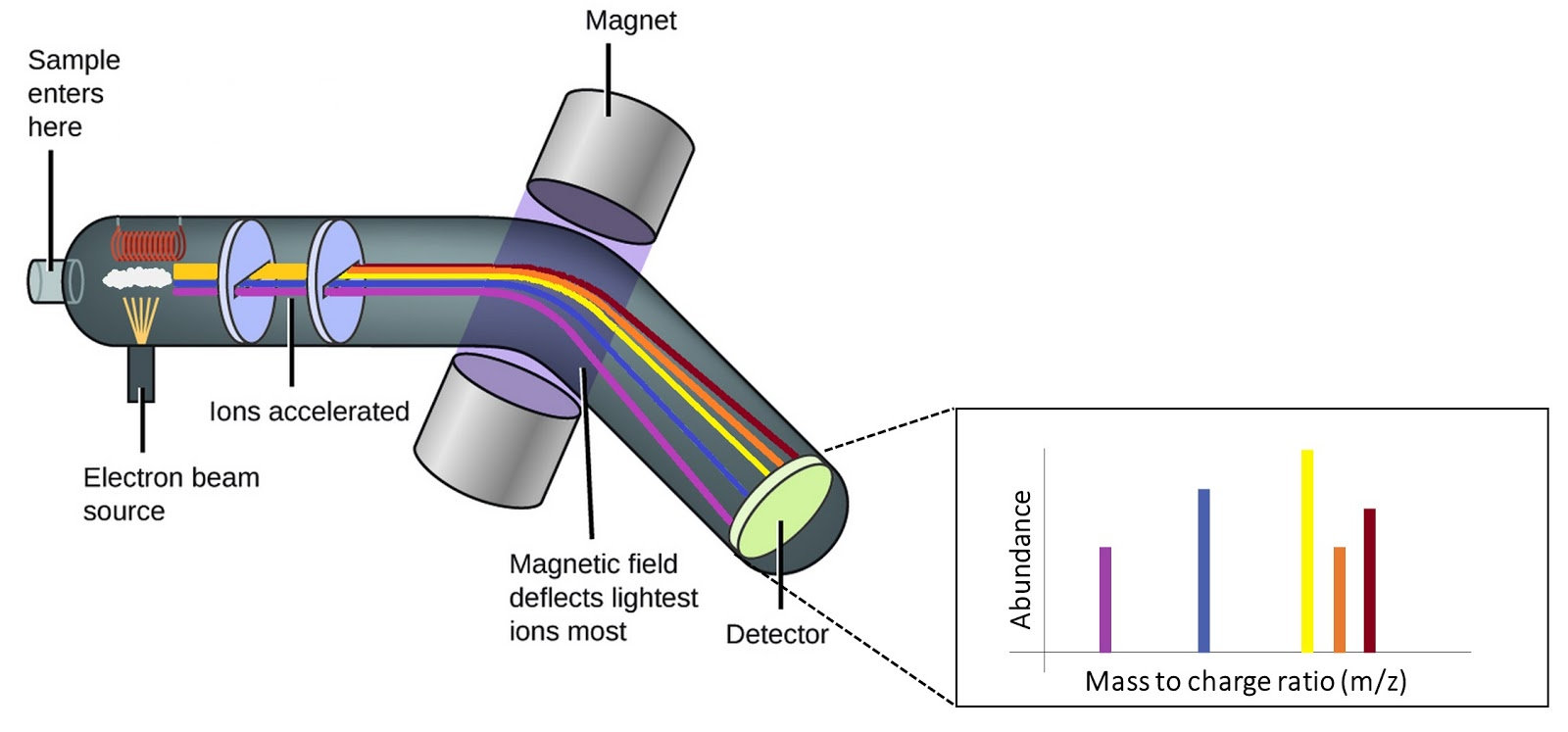
Espectroscopia de masas:
Identifica las cetonas mediante la fragmentación de sus moléculas. Al ionizar una cetona, sus enlaces se rompen en fragmentos característicos, entre ellos el del grupo carbonilo (C=O). Estos fragmentos se analizan en función de su relación masa/carga (m/z), lo que permite identificar la estructura molecular de la cetona
Aplicación
1. Industria química y farmacéutica
Disolventes: Algunas cetonas, como la acetona, se usan como disolventes en la fabricación de plásticos, pinturas, barnices y adhesivos debido a su capacidad para disolver diversos materiales.
2. Metabolismo y medicina
Cetonas en el cuerpo (cuerpos cetónicos): El cuerpo humano produce cetonas (como el β-hidroxibutirato) durante la descomposición de las grasas, especialmente durante el ayuno prolongado o las dietas cetogénicas. Estas cetonas actúan como fuente alternativa de energía para el cerebro y otros órganos cuando los niveles de glucosa son bajos.
3. Perfumería y cosmética
Perfumes: Algunas cetonas, como la acetofenona, se utilizan en la fabricación de fragancias y perfumes por su agradable olor y durabilidad.
Conservantes: Otras cetonas tienen propiedades antimicrobianas y se usan como conservantes en productos cosméticos y de cuidado personal.
Ejemplos

Experimento
Conclusión
El icopor, se descompone rápidamente cuando entra en contacto con la acetona debido a la naturaleza química de ambos materiales. El icopor es una espuma plástica que contiene una gran cantidad de gas atrapado en su estructura. La acetona, por otro lado, es un solvente muy eficaz que puede disolver muchos tipos de plásticos.